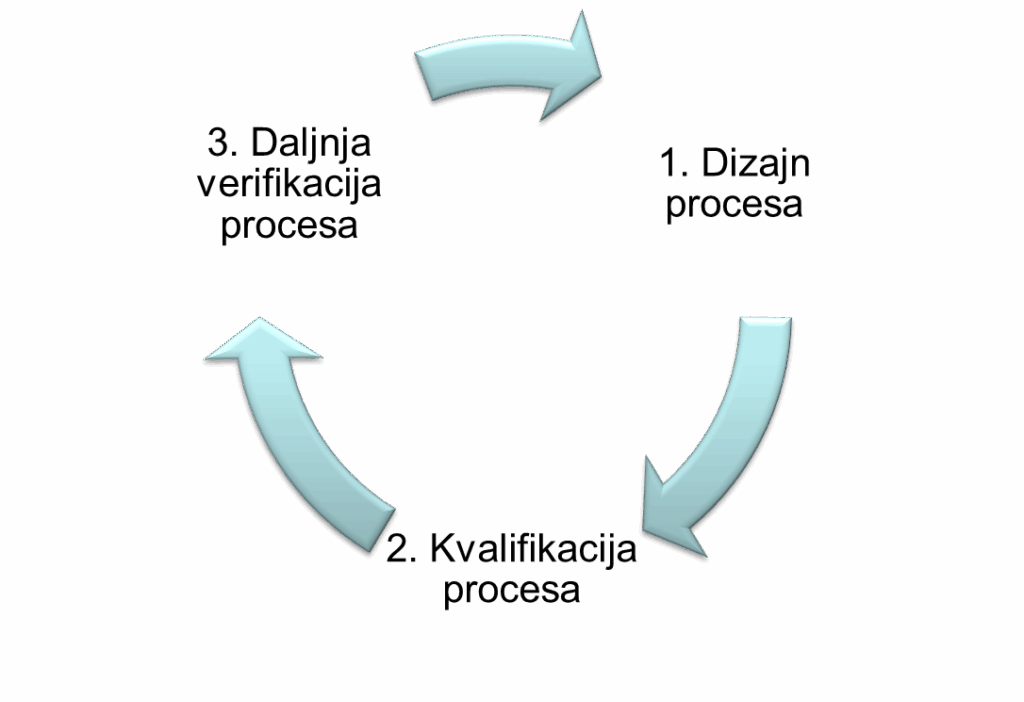
Kvalifikacija opreme u skladu s važećim smjernicama i vodičima: EU GMP Vol 4. Part I i Part II, EU GMP Annex 15, EMA Guideline on Process Validation, PIC/S PI 006, WHO Annex 4 – Appendix 6, FDA Guidance for Industry Process Validation, obuhvaća aktivnosti:
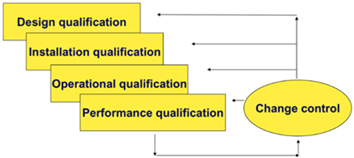
- pomoć u izradi i/ili pregled kvalifikacijske dokumentacije (specifikacija korisničkih zahtjeva (User Requirements Specification – URS), kvalifikacija dizajna (Design Qualification – DQ), testiranje prihvatljivosti kod isporučitelja (Factory Acceptance Testing – FAT), testiranje prihvatljivosti na mjestu korištenja (Site Acceptance Testing – SAT), kvalifikacija instalacija (Installation Qualification – IQ), kvalifikacija operacija (Operational Qualification – OQ), kvalifikacija rada (Performance Qualification – PQ)
- analizu rizika
- provođenje edukacije
O validaciji računalnih sustava, validaciji malih aplikacija, integritetu podataka, validaciji čišćenja i dr. možete saznati više na našim seminarima otvorenog tipa – informacije potražite na rasporedu seminara otvorenog tipa